Тема 3: Хімічні властивості лугів: дія на індикатори, взаємодія з кислотами, кислотними оксидами, солями. Заходи безпеки під час роботи з лугами.
Лабораторний дослід №2 «Взаємодія лугів з кислотами в розчині.» Інструктаж з БЖД 6-8-1
1. Опрацюй теоретичний матеріал, зроби записи в зошит.
Згадаємо!
1. Опрацюй теоретичний матеріал, зроби записи в зошит.
Згадаємо!
Хімічні властивості лугів, взаємодія їх з різними неорганічними сполуками
Усі основи – тверді речовини. За розчинністю у воді їх поділяють на розчинні – луги – і нерозчинні. Луги милкі на дотик, вони являють собою йонні сполуки. Нерозчинні основи – йонно-ковалентні сполуки.
Луги – це складні, добре розчинні у воді речовини, до складу яких входять лужні метали та гідроксильні групи. Луги беруть участь у ряді важливих хімічних реакцій, без яких неможливо уявити собі будь-яке хімічне виробництво. До лугів належать розчинні у воді основи.
Фізичні властивості
Луги є твердими речовинами білого кольору. Вони дуже гігроскопічні та відмінно розчиняються у воді. Під час взаємодії лугів з водою відбувається бурхливе виділення теплоти.
Коефіцієнт розчинності у воді залежить від радіусу катіону. Луги, що мають їдкі якості, також можуть добре та швидко розчинятися у метанолі та етанолі.
Хімічні властивості
Луги у твердому стані інтенсивно поглинають вуглекислий газ та водяну пару з повітря. Внаслідок цього луги перетворюються у карбонати.
Луги відмінно взаємодіють з кислотами з утворенням води та солі. Це є однією з найважливіших хімічних властивостей лугів. Найпростішим прикладом такої реакції є наступне рівняння:
NaOH + HCl —-> NaCl + H2O
Робочі розчини лугів добре взаємодіють з розчинами солей, у тому випадку, якщо внаслідок реакції утворюється нерозчинна сіль або нерозчинна основа.
Цей процес можна описати таким рівнянням:
2NaOH + CuSO4 —-> Cu(OH)2 + Na2SO4
Лугам характерно взаємодіяти з металами, які можуть утворювати гідроксиди та аморфні оксиди.
Таку взаємодію можна відобразити наступними рівняннями реакцій:
Zn + 2NaOH —-> Na2ZnO2 + H2
2Al + 2KOH + 2H2O —-> 2KAlO2 + 3H2
Особливістю лугів є висока реакційна здатність щодо найрізноманітніших матеріалів. Луги спричиняють руйнівний вплив на скло, порцеляну, вовну, шовк та шкіру. Під час роботи з лугами необхідно застосовувати засоби індивідуального захисту, а також дотримуватися загальних правил з техніки безпеки. Зберігати луги варто у спеціальних пластмасових упаковках.
1.Водних розчинах майже повністю дисоціюють на йони: KOH = K + OH Ca(OH)2 = Ca + 2OH 2. Змінюють забарвлення індикаторів: лакмус – синіє, фенолфталеїн стає малиновим, метиловий оранжевий - жовтим, універсальний індикаторний папір змінює колір на відтінки від зеленого до синьо-фіолетового.
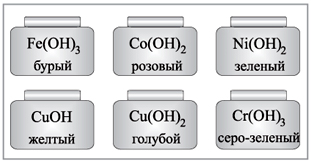
Мал 2. Забарвлення деяких лугів.
Те, як діють луги на окремі індикатори ви можете спостерігати на наступному відео.
Відео 1. Дія лугів на індикатори.
3. Взаємодіють із слабкими і сильними кислотами, утворюючи солі і воду, - реакція нейтралізації:
NaOH + HNO3 = NaNO3 + H2O
2NaOH + H2SiO3 = Na2SiO3 + 2H2O
Взаємодію лугів з кислотами можна спостерігати на наступному відео.
Відео 2. Взаємодія розчину лугів з оцтовою кислотою.
Розглянь Лабораторний дослід за посиланням, запиши його в зошит.
4. Взаємодіють з кислотними оксидами, утворюючи солі і воду:
2NaOH + O3 = Na2SO4 + H2O
5. Взаємодіють з амфотерними гідроксидами:
- у водних розчинах утворюються комплексні сполуки (залежно від співвідношення між кількостями речовин реагентів):
3NaOH + Al(OH)3 = Na3[Al(OH)6] – натрій гексагідроксоалюмінат
NaOH + Al(OH)3 = Na[Al(OH)4] – натрій тетрагідроксоалюмінат
- у розплавах утворюються безводні солі:
NaOH + Al(OH)3 = NaAlO2 + 2H2O – натрій метаалюмінат
3NaOH + Al(OH)3 = Na3AlO3 + 3H2O – натрій ортоалюмінат
6. Взаємодіють з амфотерними оксидами, утворюючи сіл і воду (тільки під час стоплення):
2NaOH + ZnO = Na2ZnO2 + H2O – натрій цинкат
2NaOH + Cr2O3 = NaCrO2 + H2O – натрій мета хроміт
7. Взаємодіють з солями у водних розчинах. Реакція необоротна, якщо хоча б один з утворених речовин випадає в осад:
2NaOH + CuCl2 = Cu(OH)2 + 2NaCl
Ba(OH)2 + K2SO4 = BaSO4 + 2KOH
Заходи безпеки під час роботи з лугами
Луги мають зберігатися у витяжній шафі, суліях, упакованих у спеціальні кошики з деревною стружкою. Ні в якому разі не зберігайте сулії незахищеними від можливого удару, а також їх відкритими в кімнаті, не можна переміщувати сулії за відсутності решетування, або самому. Не можна переміщувати їх на грудях, спині, плечах.
Мал. 4. Сулія.
3. Для розливу сулію необхідно поставити в спеціальний штатив i, обережно нахиляючи її, повільно наливати луг через лійку.
4. При роботі з лугами треба одягати гумові рукавички, клейончасті або поліетиленові нарукавники i фартух.
5. На лугах має бути напис з вказівкою виду лугу, його концентрації i додатковий напис "Звертатися обережно".
6. При проведенні аналізів луги варто відмірювати піпеткою, на вільний кінець якої попередньо надітий гумовий балончик або гумова трубка; у верхній частині піпетки повинний бути вставлений "заслін" з тонкого шару вати.
7. Місце, уражене лугом, промити великою кількістю води, а потім 2-х процентним розчином оцтової кислоти. При серйозному ушкодженні слизуватої оболонки рота докласти вчителю i негайно звернутися до лікаря.
Використання та добування лугів
Вирізняють різноманітні способи добування лугів. Основними з них є наступні:
1. Взаємодія лужних і лужноземельних металів з водою:
2Na + 2H2O = 2NaOH + H2
Ca + 2H2O = Ca(OH)2 + H2
Реакцію взаємодії лужних металів з водою ви можете спостерігати на запропонованому нижче відео.
Відео 3. Взаємодія лужних металів з водою.
2. Взаємодія оксидів лужних і лужноземельних металів з водою:
Na2O + H2O = 2NaOH
BaO + H2O = Ba(OH)2
3. Взаємодія солей з лугами, якщо в результаті реакції утворюються нерозчинні солі:
K2CO3 + Ca(OH)2 = CaCO3 + 2KOH
Na2SO4 + Ba(OH)2 = BaSO4 + 2NaOH
4. Електроліз водних розчинів. Якщо через водний розчин натрій хлориду пропустити постійний електричний струм, то на катоді виділяється водень, на аноді – хлор, а в розчині накопичується натрій гідроксид:
NaCl = Na + Cl
H2O = H + OH
На катоді: 2H = H2
На аноді: 2Cl = Cl2
У розчині в катодному просторі залишається натрій гідроксид.
Контролюючий блок 3
1. Які основні способи добування лугів ви знаєте?
2.Який газ виділяється при взаємодії лужних і лужноземельних металів з водою?
3. Що відбудеться, якщо через водний розчин натрій хлориду пропустити постійний електричний струм?
Домашнє завдання
Зробити повідомлення: Які луги, як ви знаєте, найчастіше зустрічаються у припроді? Для чого вони використовуються?
Розгадай кросворд.
Розгадай кросворд.
Цікаво знати, що…
Робити справжні феєрверки складно і небезпечно. Але ви можете зробити безпечні кольорові вогні і запалити їх під час свята з друзями. У невеликих кількостях їх можна запалювати не тільки на вулиці, але і в приміщенні.
Для приготування вогнів вам знадобиться сухий спирт, азотнокислий барій, азотнокислий стронцій і деякі інші речовини. Кожну речовину потрібно розтовкти окремо у фарфоровій ступці до одержання тонкого порошку.
Для зеленого вогню змішайте термініт з азотнокислим барієм (у рівних кількостях). Зберігайте порошки та їх суміші в скляних банках з притертими пробками, так як вони бояться вогкості.
Спалюйте суміші на металевих листах або на цеглинах. Насипте суміш гіркою діаметром 80 - 100 мм, висотою близько 20 мм і підпаліть сірником. Добре просушена суміш дає яскравий, чистий і красивий вогонь.
Спробуйте зробити вогні іншого кольору. Запам'ятайте, що полум'я забарвлюється:
в жовтий колір - хлористим натрієм (повареною сіллю),
у ліловий - вуглекислим калієм - поташем,
у синій - азотнокислої міддю.




Немає коментарів:
Дописати коментар